La materia es todo lo que ocupa un lugar en el espacio. Es todo aquello que se forma a partir de átomos o moléculas, con la propiedad de estar en estado sólido, líquido o gaseoso. Son ejemplos de materia las piedras, la madera, los huesos, el plástico, el vidrio, el aire y el agua. Al observar un paisaje pueden verse pájaros, árboles, un río, un caballo pastoreando, flores, etc. Todas esas cosas forman parte de la naturaleza y se pueden ver y tocar. Esa característica común (visible y palpable) que tienen todos los objetos se denomina materia. Es decir, la materia es lo que forman las cosas que tocamos y vemos.
La materia tiene volumen porque ocupa un lugar en el espacio. Además tiene masa, que es la cantidad de materia que posee un objeto y que se puede medir con una balanza. La materia, a diferencia de los objetos o cuerpos, no está limitada por la forma ni por el tamaño. A su vez, los objetos o cuerpos (por ejemplo una caja) pueden estar construidos por diferentes materiales (cartón, metal, madera, plástico). Por otra parte, un mismo objeto puede estar formado por uno o varios materiales (caja de madera con tapa de plástico y cerradura de metal). También, diferentes objetos pueden estar fabricados con el mismo tipo de material (balde, pelota y botella de plástico). La materia se encuentra en tres estados diferentes de agregación: sólido (hierro, madera), líquido (agua de mar) y gaseoso (aire atmosférico). En estos tres estados de agregación se observan las siguientes características:
1) La materia está formada por pequeñas partículas.
2) Esas partículas están en constante movimiento (en los gases más que en los líquidos y sólidos).
3) Hay fuerzas de atracción entre las partículas que forman la materia (en los sólidos más que en líquidos y gases).
Esas partículas, que son pequeñísimas y que forman parte de la materia se denominan átomos.
ÁTOMO
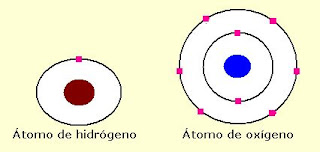
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo. Los electrones van llenando los orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa forma, el último nivel que contenga electrones puede estar completo o incompleto.
Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica. El átomo que gana electrones (queda cargado negativamente) se denomina anión. El átomo que pierde electrones (queda cargado positivamente) se llama catión. Tanto el anión como el catión reciben el nombre de "iones". Es decir, un ion es un átomo cargado eléctricamente, sea en forma positiva o negativa.
Esquema de un átomo


John Dalton propuso la denominada “Teoría Atómica” en el año 1808, donde se postula:
1- La materia está formada por partículas indivisibles y pequeñas llamadas átomos.
2- Un elemento químico es un tipo de materia formada por una sola clase de átomos.
3- Cuando los átomos de dos o más elementos se combinan forman compuestos en una razón fija de números enteros.
4- Durante una reacción química, ningún átomo desaparece o se transforma en átomos de otro elemento.
La teoría atómica dio lugar a tres leyes de la materia.
-Ley de la conservación de la masa: durante los cambios químicos no se producen modificaciones apreciables en la masa.
-Ley de la composición constante: un compuesto contiene siempre los mismos elementos y en igual razón por peso, independientemente de su origen.
-Ley de las proporciones múltiples: cuando dos elementos forman dos compuestos distintos, la relación de masa de los elementos en un compuesto está asociada a la relación de masa en el otro compuesto a través de un número sencillo y entero.
MOLÉCULA
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia. Por ejemplo, la menor porción de agua que puede existir en estado libre y conservar las propiedades del agua es la formada por 1 átomo de oxígeno y 2 de hidrógeno. La molécula es una estructura formada a partir de la unión de dos o más átomos que comparten electrones. A temperatura ambiente hay moléculas sólidas (cloruro de sodio o sal común), líquidas (agua) y gaseosas (dióxido de carbono). En síntesis, la materia está formada por partes muy pequeñas llamadas átomos. Los átomos se reúnen para constituir moléculas. A su vez, las moléculas se unen para formar sustancias. El suelo, el aire y el agua no tienen vida. Pertenecen al mundo mineral o inorgánico. La materia que forma el agua, suelo y aire se llama materia inorgánica. El árbol, el caballo y el humano, entre otros, pertenecen al mundo de los seres vivos. La materia que los forma se llama materia orgánica. Los compuestos o sustancias orgánicas son aquellos que comprenden a los hidrocarburos y sus derivados. Los hidrocarburos son elementos formados por átomos de carbono y de hidrógeno. Las sustancias inorgánicas comprenden a los restantes compuestos químicos que, en general, se encuentran en la naturaleza como minerales.
Molécula de agua

Molécula de oxígeno

PROPIEDADES DE LA MATERIA

ESTADOS DE LA MATERIA
El estado en que se encuentra la materia (sólido, líquido y gaseoso) depende de la energía que poseen las partículas (átomos, moléculas y iones) que constituyen la materia, y de las fuerzas de atracción que existen entre ellas. Además, también depende de las condiciones de temperatura y presión a las que están sometidas esas partículas.
Estado sólido
Las partículas que forman los sólidos se atraen fuertemente, están cerca unas de otras y dispuestas de manera ordenada, lo que le dan la característica de ser estructuras rígidas. Tienen poco espacio para moverse, ya que solo pueden hacerlo vibrando en posiciones fijas. Esta particularidad les da la característica de tener forma y volumen constantes.
Estado líquido
Las partículas que forman los líquidos se atraen parcialmente y tienen más libertad para moverse que en los sólidos, pero no llegan a separarse de las demás, por lo que conservan su volumen. Esas partículas disponen de más espacio y pueden deslizarse unas sobre otras con facilidad. Esto explica por qué los líquidos tienen forma variable, adoptando la del recipiente que los contiene. Una característica de los líquidos es la fluidez, ya que pueden trasladarse hacia otros lugares y atravesar orificios muy pequeños. Otra propiedad es la viscosidad, debido a que poseen cierta dificultad para desplazarse a raíz del rozamiento de sus partículas.
Estado gaseoso
En los gases prácticamente no existen fuerzas de atracción que mantengan unidas las partículas que los forman. Es por eso que sus partículas están muy separadas entre sí y existe más espacio vacío que en los líquidos o en los sólidos. Ello permite que se muevan con mayor facilidad, al azar y con bastante rapidez. Así se explica que los gases tengan una forma y un volumen variables y sean expansibles, es decir, ocupen todo el espacio disponible.

Cambios de estado de la materia
 CLASIFICACIÓN DE LA MATERIA
CLASIFICACIÓN DE LA MATERIALa materia se clasifica en sustancias puras y mezclas. Las sustancias puras, que a su vez pueden ser simples y compuestas, se caracterizan por tener composiciones fijas y responder a propiedades constantes. Las sustancias compuestas pueden separarse mediante procedimientos químicos.
Las mezclas están formadas por dos o más sustancias puras y se dividen en homogéneas y heterogéneas. Los componentes de una mezcla se pueden separar utilizando procesos físicos.
 SUSTANCIAS PURAS
SUSTANCIAS PURASUna sustancia es cualquier variedad de la materia de aspecto homogéneo que comparte determinadas propiedades, como el color, la densidad, la temperatura de ebullición y la temperatura de fusión, entre otras. Esto hace que cada sustancia pueda distinguirse de otra sustancia.
Las sustancias simples están formadas por átomos de un solo elemento que no pueden fragmentarse en elementos más simples utilizando métodos físicos o químicos comunes. Son sustancias simples los elementos que figuran en la tabla periódica de los elementos, como el oxígeno, el carbono, el nitrógeno, el azufre, etc.
Las sustancias compuestas son aquellas sustancias puras que contienen dos o más elementos fijos, con lo cual siempre tienen los mismos elementos en su composición. Las sustancias compuestas se representan por medio de fórmulas químicas. La molécula del agua está formada por dos átomos de hidrógeno y uno de oxígeno. El dióxido de carbono posee dos átomos de oxígeno y uno de carbono. Además del agua y del dióxido de carbono, son ejemplos de sustancias compuestas el metano, el cloruro de sodio, la glucosa, la urea, el amoníaco y el alcohol etílico.
Para separar los elementos de una sustancia compuesta se puede recurrir a procesos químicos. Por ejemplo, sometiendo a elevadas temperaturas al dióxido de mercurio es posible obtener los elementos constituyentes de dicha sustancia. Otra forma de separación es la electrólisis, que consiste en someter a un determinado compuesto a una corriente eléctrica. La electrólisis del agua separa sus elementos constituyentes, obteniéndose los gases hidrógeno y oxígeno. La utilización de procesos químicos de separación produce destrucción de las sustancias componentes.
MEZCLAS
Son materiales que se forman al combinar dos o más sustancias puras, sin que ello ocasione cambios químicos en esas sustancias. Por medio de métodos físicos, las mezclas pueden separarse de sus componentes sin producir alteración en los mismos. Existen dos tipos de mezclas, las homogéneas y las heterogéneas.
Las mezclas homogéneas son soluciones, formadas por un solvente generalmente en mayor proporción y uno o más solutos en cantidades menores. Tienen la misma composición en toda la muestra por lo que son uniformes, con lo cual presentan una sola fase. Sus partículas, que no pueden distinguirse a simple vista ni aún bajo el microscopio, se mueven al azar y de manera constante. Tienen un tamaño entre 0,1 y 10 nanómetros (nm) y se encuentran dispersadas como moléculas, átomos o iones.
 Las mezclas homogéneas son transparentes y sus componentes no se separan durante el reposo. La soda es una solución formada por un solvente, el agua, y un soluto, el dióxido de carbono. Otros ejemplos de soluciones, o mezclas homogéneas, son el agua de mar, el aire, el agua azucarada, las bebidas gaseosas, el vinagre y la lavandina.
Las mezclas homogéneas son transparentes y sus componentes no se separan durante el reposo. La soda es una solución formada por un solvente, el agua, y un soluto, el dióxido de carbono. Otros ejemplos de soluciones, o mezclas homogéneas, son el agua de mar, el aire, el agua azucarada, las bebidas gaseosas, el vinagre y la lavandina. La evaporación y la destilación son métodos para separar los componentes de una mezcla homogénea. Cuando la solución está formada por un líquido y un sólido se emplea la evaporación. Una solución salina puede separarse evaporando el líquido, que se recupera condensando el vapor. El sólido, en este caso la sal, queda depositado en el fondo del recipiente. Si la mezcla homogénea está formada por dos líquidos se utiliza la destilación, en la medida que ambos componentes tengan diferente punto de ebullición. La sustancia más volátil se desprenderá primero de la mezcla, que se recupera por condensación. Mediante la destilación se puede separar el alcohol que forma parte del vino.
 Las mezclas heterogéneas son aquellas donde sus componentes pueden distinguirse a simple vista o con el microscopio, con lo cual no son uniformes. Por ejemplo la arena en agua, o piedras con carbón son mezclas heterogéneas groseras que se aprecian fácilmente y varían de un punto a otro. Además, dentro de las mezclas heterogéneas se distinguen las suspensiones y los coloides. Las suspensiones son mezclas heterogéneas formadas por una fase dispersa, es decir, un soluto sólido insoluble y una fase dispersante, representada por un líquido. Las partículas de la fase dispersa son mayores a 100 nanómetros de tamaño, pueden observarse a simple vista y sedimentan cuando la suspensión está en reposo. Las suspensiones tienen aspecto opaco como el aceite en agua, los jugos de frutas, la arcilla en agua y las pinturas al agua.
Las mezclas heterogéneas son aquellas donde sus componentes pueden distinguirse a simple vista o con el microscopio, con lo cual no son uniformes. Por ejemplo la arena en agua, o piedras con carbón son mezclas heterogéneas groseras que se aprecian fácilmente y varían de un punto a otro. Además, dentro de las mezclas heterogéneas se distinguen las suspensiones y los coloides. Las suspensiones son mezclas heterogéneas formadas por una fase dispersa, es decir, un soluto sólido insoluble y una fase dispersante, representada por un líquido. Las partículas de la fase dispersa son mayores a 100 nanómetros de tamaño, pueden observarse a simple vista y sedimentan cuando la suspensión está en reposo. Las suspensiones tienen aspecto opaco como el aceite en agua, los jugos de frutas, la arcilla en agua y las pinturas al agua.Los coloides son mezclas heterogéneas cuyas partículas, entre 10 y 100 nanómetros, son más pequeñas que las correspondientes a las suspensiones, pero más grandes que las moléculas que forman las soluciones. Un coloide es un sistema formado por una fase continua, en general líquida, y otra fase dispersa a modo de partículas, normalmente sólidas. Sus partículas no se separan si están en reposo y poseen una opacidad menor que las suspensiones. Los coloides también tienen una fase dispersa representada por partículas del tamaño antes indicado que se distribuyen en una fase dispersante, similar al solvente de las soluciones. Son mezclas heterogéneas coloidales la sangre, la leche, el flan, las gelatinas, el vino, la cerveza, la tinta china, las pinturas, la mayonesa, la clara de huevo, el humo y la neblina.
 Son varios los métodos de separación de las mezclas homogéneas, sobresaliendo las siguientes.
Son varios los métodos de separación de las mezclas homogéneas, sobresaliendo las siguientes.-Tamización: procedimiento donde las partículas sólidas se pueden separar a raíz de su diferente tamaño. Se utilizan coladores con orificios de distintas dimensiones. Por este método, por ejemplo, se pueden separar pequeñas rocas mezcladas con arena gruesa y con sal.
-Imantación: cuando uno de los componentes de la mezcla es atraído por los imanes, no así la otra, por ejemplo partículas de hierro mezcladas con arena.
-Decantación: se utiliza en mezclas heterogéneas de dos líquidos o de un sólido en un líquido. Este método físico se basa en las diferentes densidades de los componentes. La mezcla se deja reposar hasta que descienda uno de los constituyentes y pueda extraerse. Las suspensiones se separan por decantación, tal los casos del agua en aceite o el agua con tierra.
-Filtración: este método permite separar un sólido de un líquido, haciendo pasar la mezcla por un filtro de papel donde queda retenido el sólido.
-Centrifugación: procedimiento donde se separan materiales de distinta densidad mediante rotación sobre un eje fijo a velocidad rápida y constante. Los componentes más densos se ubican en el fondo del recipiente o tubo de la centrífuga.
 Fuente: "CIENCIAS BIOLÓGICAS" - http://hnncbiol.blogspot.com
Fuente: "CIENCIAS BIOLÓGICAS" - http://hnncbiol.blogspot.com










43 comentarios :
jooh mañana voy a sacar un 10 gracias!!me a servido de mucho me paare por aqui mas amenudo
12años
boooh yo no creo q saq ni un 5 esto no m sirvio de nada
jusjus era broma andrea jeje no t piqes cn migo wapa
tqiero
alis_ilovepink
me sirvio de mucho muy buena tarea seguro me saco 10.o
soy: angelica gallego robledo
te faltan muchos ordenes
ojala saque buena nota!!
MUCHAS GRACIAS
ESPEROO ME AYUDEE :)
CREO QUE SACARE UN 9 O ALGO POR EL ESTILO
SIRVE DEMASIADO :)
ES MUY CONCRETO Y CON IMAGENES
FELICITACIONES!
ESTA PAGINA ES UN TRABAJO EXCELENTE
NOS SIRVIO DE MUCHO COMO CONSULTA
SIGE ASI LUCHANDO POR EL APRENDIZAJE DE LOS ESTUDIANTES
GRACIAS POR PREOCUPARTE POR AQUELLAS TAREAS QUE NOS DEJAN Y NOS AYUDAS A RESOLVERLAS
CHAITO
TE CUIDAS BESHOS
esta super yo creo que esta todo lo que necesito soy gustavo basurto n (LEO)
por fa necesito que me ayuden hoy sere yo mañana uds plisssss
necesito explicar con base en ejemplos como es que la quimica estudia a la materia....
se los ruego
quien me pueda y quiera ayudar mi msn es yas.1418@hotmail.com
querer es poder
gracias
yasmin...
Waaoouu
stoo me sirviio de muchooo
sii ke cii haha deseguroo sakoo 10
hah poes Graciias por la informaciion waaaa__^^
kuiidensee
haha wili te amoooo♥
getsi_shaparra@hotmail.com
www.metroflog.com/Getszi
Baeeeee
umm no me sirvio de mucho por que mas que nada queria saber sobre los5 estados de la materia pero esta bn gracias
m gracias kon esto me sako 10. con este maestra k tengo de quimica es muy molesto
aqui no aparece ni la estructura de la materia ni sus propiedades NIII sus caracteristicas q clase de pagina es sta ñoña
La pagina esta bastante desarrollada,poco pero la información que tiene es bastante buena. Espero me sirva pues estudio 7mo... Gracis..
los felicito porque me fue de mucha ayuda el material que han editado. empiezo una carrera donde gran pare de las materias son fisica y quimica. en las clases iniciales hicimos un repaso de los contenidos de secundaria y la verdad no me acordaba hasta que me puse a leer algunos apuntes y luego entre a esta pagina. muchas gracias y que Dios les siga dando sabiduria. vane
La pagina e muy buena en 2 dias tengo prueba y esto me sirvio de mucha ayuda GRACIAS POR LA INFORMACION
la pagina es muy buena en 2 días tengo que entregar una información y esta pagina me sirvió de mucho gracias por la información
muy buena info
LA VERDAD QUE TRAY BUENA INFORMACION QUE ME AYUDARA DEMASIADO ¡GRACIAS!
voy a suspender el examen SEGURO!!!!!!!!!!!!!
QUE CHEVERE ESE CABALLITO
buena pag falta complementar un poco mas... exitos :)
buena informacion amigos.
hola la verdad me sirva bastante grasias :)
me agrada esta pagina!exelente!GRACIAS
El tema està muy claro, preciso, facil de entender. Habìa leìdo varios textos pero ninguno tan claro.
Felicitaciones.
Espero encontrar tambièn las teorìas atòmicas muy actualizadas y entendibles gracias
excelente trabajo, muy facil de entender. Delena
esta bueno esto me sirve d mucho gracias
Muy bueno me sirvio mucho gracias!!
me sirvio muchísimo
me sirvi mucho me voy a sacar un 5 por atrosado jajajaja trolazo LOL
:) :(
Me encanto esta Pagina ! Tiene un monton de informacion y aca esta todo lo que yo necesito !
me sirve bastante sigan asi me gusta su pagina saque 10 grasiasssssss la pagina es buena voy a visitarla mas seguido para mis tareasss
Esta muy buena esta pagina, me ayudo muxo, gracias q Dios te Bendiga
muchas gracias me fue de mucha ayuda!!!!!!!!
debajo de la tabla de suspensiones, coloides y soluciones aparece un error, en cuanto a la mezcla
MUY BIEN
es una buena información gracias por preocuparese en subir este tipo de información y espero que lo sigan haciendo
exelente trabajo
Wow espero que me sirva.. Se ve que le pusieron dedicación y tiempo para hacer esto ojala me ayude ahora (voy en 7-b) gracias
Gracias, excelente tema, muy explicito. Bendiciones.
muy buena me ayudo mucho...
muy buena informacion
Nesecito bien especificado la composición de la materia. Por favor gracias.
Publicar un comentario